configurația electronică 2
Configurația electronică este de obicei scrisă pentru atomi în starea lor la sol. Pentru a determina configurația elementului electronice, se aplică următoarele reguli:
- principiu de umplere. Conform principiului umplerii, electronii din starea fundamentală atomic orbital este umplută în creștere secvență nivelurile de energie orbitale. orbitali de energie mai mici sunt întotdeauna umplute mai întâi.
- principiul de excluziune. Conform acestui principiu, în orice orbital poate fi nu mai mult de doi electroni și apoi numai dacă au rotiri opuse (numere de spin inegale).
- regula lui Hund. Conform acestei reguli, umplutura începe orbitali unul electroni subshell cu o singură paralelă (semnul egal) se rotește și numai după ce electronii singure ocupa toate orbitali pot să apară finale Orbitali umplere perechi de electroni cu spin opus.
Din punct de vedere al mecanicii cuantice, configurația de electroni - o listă completă a funcțiilor de undă-un electron. din care cu suficientă precizie poate face pe deplin atom funcția de undă (în sine domeniu).
In general vorbind, atomul, ca un sistem integral, este posibil să se descrie în întregime numai funcția totală de undă. Cu toate acestea, o astfel de descriere este practic imposibil pentru atomii de hidrogen este mai dificil - cea mai simplă dintre toți atomii elementelor chimice. Convenabil descrierea aproximativă - o metodă de câmp self-consistent. În această metodă, introducem conceptul funcției de undă a fiecărui electron. Funcția de undă a întregului sistem este scris despre produs ca simmetrizovanoe corespunzător funcțiilor de undă-un electron. La calcularea funcției de undă a fiecărui câmp de electroni al tuturor celorlalte electroni este considerat ca potențial extern. care depinde la rândul său, cu privire la funcțiile de undă ale altor electroni.
Ca rezultat al aplicării metodei câmpului autoconsistentă obținut sistem complex de ecuații integro-diferențiale neliniare. care este încă dificil de rezolvat. Cu toate acestea, ecuațiile de câmp auto-consistente au simetrie de rotație a problemei inițiale (adică, ei sunt simetrie sferică). Acesta vă permite să clasifice pe deplin funcțiile de undă de un electron care formează funcția totală de undă a atomului.
Pentru început, la fel ca în orice potențial central simetric, funcția de undă în domeniul autoconsistentă poate fi caracterizată prin numărul cuantic al momentului total de l unghiulare și numărul cuantic de proiecție a momentului cinetic pe orice axă m. Funcțiile de undă cu valori diferite ale m corespund același nivel energetic, adică. E. degenerată. De asemenea, un singur nivel de energie corespunde cu stările diferite de proiecție de spin de electroni pe orice axă. Puterea totală pentru un anumit nivel de 2 (2 l + 1) ale funcțiilor de undă. Mai mult, pentru o anumită valoare a momentului cinetic pot fi enumerate nivelurile de energie. Prin analogie cu numerotarea atom de hidrogen adoptat pentru nivelurile de energie începând cu l n = l + 1. O listă completă a numerelor cuantice de funcții de undă de electroni de la care se poate face funcția de undă a atomului, și se numește configurația de electroni. Din moment ce totul este degenerat în numărul cuantic m, iar pe partea din spate, este suficient pentru a indica numărul total de electroni într-o stare cu n date. l.
Descifrarea configurația electronică
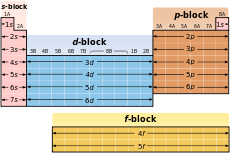
configurație electronică Tabel
Din motive istorice, în formula de configurare de electroni numărul cuantic L este scris cu litere latine. Statul cu l = 0 este notat cu s. p. l = 1. d. l = 2. f. l = 3. g. l = 4 și apoi în ordine alfabetică. În partea stângă a numărului l numărul de scriere n. și pe partea de sus a numărul L - numărul de electroni într-o stare cu date și n l. Exemplul 2 s 2> corespunde doi electroni în stare cu n = 2. l = 0. Din cauza conveniență practice (a se vedea. Principiul Aufbau) de configurare termeni complet electronice formula de scriere în ordinea creșterii numărului cuantic n. si apoi numarul cuantic l. de exemplu, s 1 s 02 februarie 02 februarie 06 martie p s p2 3 martie 2s ^ 2p ^ 3s ^ 3p ^>. Deoarece o astfel de înregistrare redundante multiple, uneori abreviat cu formula 1 2 s 2 s 2 s 3 iunie p 2 p 3 2s ^ p ^ 3s ^ p ^>. t. e. reduce numărul n, în cazul în care este posibil să se ghicească din termenii regulilor de ordonare.
legea periodică și structura atomului
Toți au fost implicați în probleme de structură atomică în toate studiile lor se bazează pe instrumentele care le sunt furnizate de lege periodice. deschis chimist D. I. Mendeleevym; Numai în înțelegerea sa a legii de fizică și matematică folosită pentru a interpreta relația ei se arată „limba“ lui (dar cunoscut aforism destul de ironic, George. W. Gibbs pe această temă [1]), dar, în același timp, izolată de chimiști studiu materie, cu toată perfecțiunea, beneficiile și versatilitatea vehiculelor lor, fie fizica sau matematica, desigur, pentru a construi lor de cercetare nu se poate.
Interacțiunea dintre reprezentanții acestor discipline are loc în dezvoltarea viitoare a temei. Deschiderea periodicității secundare E. V. Bironom (1915), a dat o altă dimensiune la înțelegerea problemelor legate de legile structurii cojile de electroni. C. A. Shchukarev. elev E. V. Birona și M. S. Vrevskogo. unul dintre primii la începutul anilor 1920 a sugerat că „frecvența este o proprietate inerentă în nucleu.“
Cu această claritate completă în înțelegerea cauzelor a frecvenței secundare nu este până în prezent, există o vedere cu privire la această problemă, se înțelege că unul dintre principalele motive pentru acest fenomen este deschis S. A. Schukarevym kaynosimmetriya - prima manifestare a unei noi simetrie orbitale (Alții- . καινός greacă - συμμετρία greacă noi și vechi -. simetrie "kaynosimmetriya", adică "noi simetrie"). Kaynosimmetriki - hidrogen și heliu. a cărui e acolo orbitale. - elemente de bor la neon (orbital - p), - elementele primei serii de tranziție de la scandiu la zinc (orbital - d), și - lantanide (Termenul S. A. Schukarevym propus ca actinide) (orbital - f). După cum se știe, elementele care sunt kaynosimmetrikami, în multe privințe, au proprietăți fizice și chimice diferite de cele ale altor elemente care aparțin aceluiași subgrup.
fizică nucleară a făcut posibilă pentru a elimina controversa asociată cu „interdicția“ Lyudviga Prandtlya [2]. În 1920 ani același S. A. Schukarev formulate, în general, izotopul statistici, care prevede că în natură nu pot fi doi izotopi stabili de același număr de masă și sarcină a nucleului atomic, care diferă de unul - una dintre ele trebuie să fie radioactive. Formularul complet, acest model a achiziționat în 1934, datorită fizicianul austriac J. Mattauhu, și să obțină numele corect interdicția Mattauha-Shchukarev. [3] [4]