Configurația electronică a atomilor
Electronii din nucleul nu sunt aranjate la întâmplare, și straturi - nivelul de energie. Aceste niveluri sunt etaje în clădirea - primul, al doilea, al treilea și așa mai departe.
Și chiar și în fiecare nivel există subnivele electronice - s, p, d, f, care sunt aranjate Orbitali respectiv atomice s, p, d, tip f.
Cu cât numărul „podea“ - nivel, „mai sus“ (în continuare din nucleu) sunt electroni acel nivel.
La primul nivel poate fi un singur s-subnivel,
al doilea pentru două subnivele: s și p.
- a treia „trei subnivele (s, p și d), pe a patra - patru (s, p, d, f).
subnivele electronice, precum și de energie și pardoseli - nivelurile variază de la putere.
Acestea sunt situate la diferite de energie „ridicat“.
Oamenii de știință sunt de acord pentru a desemna fiecare orbital atomic
celula cuantică - pătrat pe diagrama de energie:
Pe -podurovne s poate fi un orbital atomic, iar p -podurovne pot exista trei (conform celor trei axe de coordonate):
Orbitalii d - și f -podurovnya într-un atom poate avea cinci și șapte, respectiv:
Fiecare electron va fi notată cu o săgeată orientată în sus sau în jos, și, în același timp, doar sunt de acord că în caseta cuantică poate fi plasat cel mult doi electroni cu săgeți care indică în direcții diferite, astfel:
pe deplin populate cu electroni
Toate nivelurile și subnivele electronice, pe care tocmai l-am descris ca diagrame, sunt caracterizate printr-o anumită energie.
Și cel mai important, pentru toți electronii dintr-un atom, această „anumită energie“ are o valoare negativă (mai mică decât 0), și este chiar mai negativă decât orbital mai aproape de nucleu.
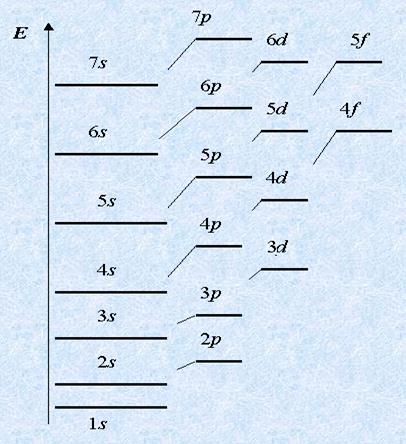
Primul este umplut cu nivelul cel mai profitabil energie în primul rând, și abia apoi al doilea, al treilea și așa mai departe. Mai mult decât atât, în cadrul aceluiași nivel este mai întâi umplut cu substratul a cărui energie este mai mic. De exemplu, primii doi electroni cad pe 2s-subnivelul, și apoi - 2p subnivel; Primele 3s, și apoi 3p subnivel.
Dar apoi confuzia începe: după 4s umplut nu 4P, și 3D-subnivel. Dar numai la prima vedere. De fapt, totul este în conformitate cu normele, deoarece energia 3d-subnivelul mai mici decât 4p. De aceea, el este ocupat cu electroni inainte.
Mutarea in orbitali atomice ale electronilor. De obicei, un minim de energie, principiul de excludere al lui Pauli și regula lui Hund
Stabilindu orbitali atomici cu electroni regula determinat principiu minim de energie Pauli și regula lui Hund.
Electronii ocupă orbitali atomici, deoarece cu o energie subnivel mai mic. Aceasta este, de obicei, un minim de energie. Coerența în energie acumularea Care sunt subnivele: 1s <2s <2p <3s <3p <4s ≤ 3d <4p <5s и так далее …
Conform calculelor, electronul nu se deplasează pe orice cale specială, și poate fi în orice parte a spațiului perinuclear - adică, putem vorbi doar despre probabilitatea (posibilitatea) locației sale la o anumită distanță de nucleu.
Electronii din atomii ocupă orbitalii atomici energetice favorabile (orbitalii cea mai mică energie) pentru a forma nori de electroni de o anumită formă.
În cazul norului de electroni-s orbital este sferic:
În cazul p-orbitali formează nor de electroni halteră :.
In interiorul orbitalii atomice ale probabilitatea de a găsi un electron este mare; Cu alte cuvinte, există o densitate mare de electroni. Spațiul în afara domeniului de aplicare al orbitalii corespunde unei densități de electroni scăzută.
In fiecare orbital atomic poate fi plasat maximum doi electroni (principiul lui Pauli).
În prezența orbitalii de aceeași energie (de exemplu, cele trei orbitali p un subnivel) fiecare orbital este umplut prima repriză (și, prin urmare, asupra p sub-strat nu poate fi mai mare de trei electroni nepereche) și apoi complet pentru a forma perechi de electroni (regula Hund lui) .
Numărul de posibile subnivele egal cu numărul de nivel. Primul nivel este format dintr-un singur
s-subnivel. Al doilea strat este format din două subnivele - s si p. Al treilea nivel - trei subnivele - s, p și d.
Fiecare subnivel poate fi sever restricționată de numărul de electroni:
pe e-subnivelul - nu mai 2e;
pe p-subnivelul - nu mai 6E;
pe d-subnivelul - nu mai mult de 10s.
un nivel de sub-niveluri sunt completate în strictă ordine: s p d.
Astfel, p-subnivele nu poate începe să umple, în cazul în care nu s-umplut substrat al nivelului de energie, etc.
Diagrama energetica a cojilor de electroni de atomi de hidrogen și heliu:
atom de hidrogen poate pierde electronul unic, care este de asemenea exterioară și valență și transformat într-un cation de hidrogen:
H 0 - 1, e = H +
Acest lucru înseamnă că hidrogenul este oxidat - participă la procesul de oxidare. Dar un atom de hidrogen poate fi restaurat și - pentru a accepta electroni. Procesul de recuperare va anion de hidrogen, care este de asemenea numit un anion hidrură:
H 0 1 + e = H -
Atomul de carbon a devenit capabil nu numai să renunțe la electronii lor - oxidat, dar, de asemenea, să ia - pentru a recupera:
C 0 - 4 e- = C + IV
C 0 + 4 e = C -IV
Cationii reale și anioni de carbon există, prin urmare, în ecuațiile de mai sus reacțiile aici scrise atomi de carbon caractere în stare de oxidare + IV și -IV.
Starea de oxidare - această sarcină condiționată, care poate fi atomii diferitelor elemente în compuși chimici.
Unele modele în Tabelul periodic D. Mendeleev.
Tabelul periodic aranjează nu numai elementele, ci și o gamă largă de proprietăți. Chimist este adesea suficient pentru a avea în fața ochilor mei Tabelului periodic, pentru a răspunde în mod corect o mulțime de întrebări (nu doar examenul, dar, de asemenea, științifice).
Să ne uităm din nou la tabelul periodic. În plus față de legătura fundamentală profundă între elementele, aceasta reflectă un număr de util pentru studiul legilor chimiei. Luați în considerare cele mai importante dintre ele (Fig.).
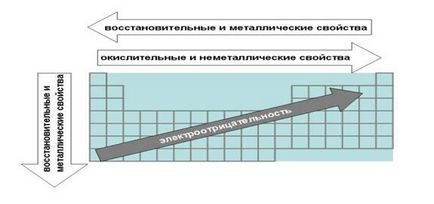
Fig. Legile Tabelului Periodic, asociate cu elementele metalice și proprietăți redox electronegative.
a) Legile referitoare la proprietățile nemetalice ale elementelor metalice și.
1. Atunci când se deplasează de la dreapta la stânga de-a lungul proprietatile elementului metalic de epocă îmbunătățite. În direcția opusă crește nemetalic.
Acest lucru se datorează faptului că regulile sunt elementele, care cojile de electroni mai aproape de octetul. Elementele din partea dreaptă a perioadei mai puțin probabil să renunțe la electronii pentru a forma o legătură metalică, și în general în reacțiile chimice.
De exemplu, carbon - metaloid mai pronunțată decât vecinul său în bor perioadă și atomul de azot are un proprietăți nemetalice mai vii decât carbon.
De la stânga la dreapta într-o perioadă, de asemenea, a crescut, iar sarcina nucleului. Prin urmare, creșterea gradului de atractivitate a electronilor de valență de bază și a împiedicat reculul lor.

c) Legile referitoare la dimensiunile atomilor.
6. Dimensiuni atomi (raza atomică), atunci când se deplasează la stânga la dreapta de-a lungul scăderilor perioadei. Acest lucru este atribuit faptului că electronii sunt din ce în ce atrase de nucleu pe măsură ce crește taxa nucleare. Chiar și o creștere a numărului de electroni din învelișul exterior (de exemplu, fluor, în comparație cu oxigenul) nu crește dimensiunea unui atom. Dimpotrivă, dimensiunile atom de fluor este mai mică decât atomul de oxigen (Fig. 4).
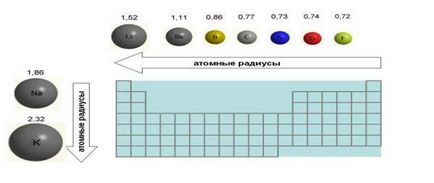
Fig. Schimbarea razelor atomice ale elementelor exemplu din două perioade și lotul 1 a tabelului periodic. Razele atomice date în angstromi (1 A = 10 -8 cm).
7. Atunci când se deplasează de sus în jos elemente de raze atomice sunt în creștere, deoarece este umplut cu mai multe scoici electronice.
Periodicheskiyzakon Mendeleev: proprietatile elementelor chimice, precum și proprietăți de compuși simpli și complecși formate de acestea sunt responsabile periodic, în funcție de nucleele atomilor.
Sensul fizic al legii periodice: proprietățile elementelor chimice se repetă periodic, deoarece repetă periodic configurărilor electroni de valență (distribuție de electroni și niveluri externe penultimele).