configurația electronică
Configurația electronică a elementului este distribuția electronilor în atomii săi de înregistrare de scoici, subshell și orbitali. Configurația electronică este de obicei scrisă pentru atomi în starea lor la sol. configurația atomică electronică în care unul sau mai mulți electroni într-o stare excitată se numește configurație excitat. Pentru a determina configurația specifică a elementului electronice în starea solului, următoarele trei reguli: Regula 1: umplere principiu. Conform principiului umplerii, electronii din starea fundamentală atomic orbital este umplută în creștere secvență nivelurile de energie orbitale. orbitali de energie mai mici sunt întotdeauna umplute mai întâi.
hidrogen; numărul atomic = 1; numărul de electroni = 1
Acest electron într-un atom de hidrogen trebuie să ocupe s-orbitale ale K-span de aproximativ datorită tuturor posibile orbitalii are cea mai joasa energie (vezi. Fig. 1.21). Electroni pe acest s-orbital se numește ls-electron. Hidrogen în stare sol are o configurație electronică Is1.
Regula 2: principiul de excluziune. Conform acestui principiu, în orice orbital poate fi nu mai mult de doi electroni și apoi numai dacă au rotiri opuse (numere de spin inegale).
litiu; Număr atomic = 3; numărul de electroni = 3
Orbital cu cea mai mică energie este 1s-orbital a. Se poate lua doar doi electroni. Acești electroni trebuie să fie inegale înapoi. Dacă notat spin +1/2 săgeată îndreptat în sus și spin -1/2 săgeată cu vârful în jos, cei doi electroni cu opus (antiparalel) se rotește în același orbital poate fi schematic reprezentat un record (fig. 1.27)
Într-un orbital nu poate fi doi electroni cu aceeași (paralelă) se rotește:
Al treilea electron dintr-un atom de litiu ar trebui să ocupe energia orbitală a imferior orbitale, adică 2c-orbital. Astfel, litiu este configurat electronic Is22s1.
Regula 3: regula Hund. Conform acestei reguli, umplutura începe orbitali unul electroni subshell cu o singură paralelă (semnul egal) se rotește și numai după ce electronii singure ocupa toate orbitali pot să apară finale Orbitali umplere perechi de electroni cu spin opus.
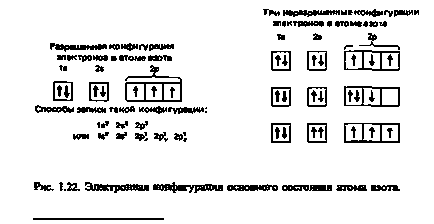
azot; număr atomic = 7; numărul de electroni = 7 Nitrogen are ls22s22p3 configurația electronică. Trei electroni la subshell 2p, ar trebui să fie plasate unul câte unul pe fiecare din cele trei 2p orbitali. În același timp, toate cele trei electron trebuie să aibă rotiri paralele (Fig. 1.22).
Tabel. 1.6 prezintă configurația electronică a elementelor cu un număr atomic de la 1 la 20.
Tabelul 1.6. Configurația electronică a stării solului pentru elementele cu număr atomic de la 1 la 20
