proces adiabatic
Adiabatică (adiabatic) proces este un proces care are loc într-un sistem termodinamic în absența schimbului de căldură cu organele din jur, adică priQ = 0.
UslovieQ = 0 condiție necesară, dar nu suficientă pentru un proces adiabatic. Această condiție poate corespunde proceselor în care pe unele părți ale sistemului primește căldură, iar pe de altă parte oferă, astfel încât căldura totală produsă (sistem dat poate fi egal cu zero. Când sistemul de proces adiabatic pe orice porțiune infinitezimale nu primește și nu dă căldură. Practic procesele adiabatice au loc suficient de rapid și cu sisteme de izolare perfectă. Deoarece procesul adiabatic
căldura gazului în timpul acestui proces,
Prima lege a termodinamicii pentru procesul adiabatic este după cum urmează:
PDV = -
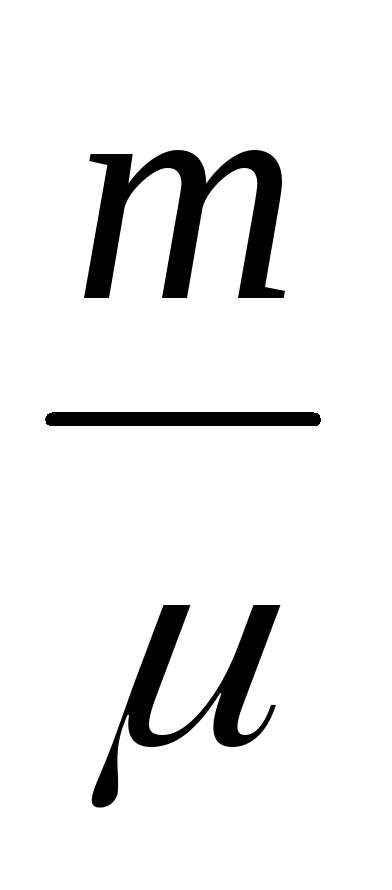
pv =
PDV + VDP =
ecuația Divide (2) pe ecuația (1)
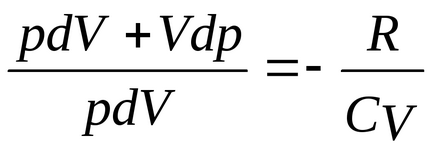
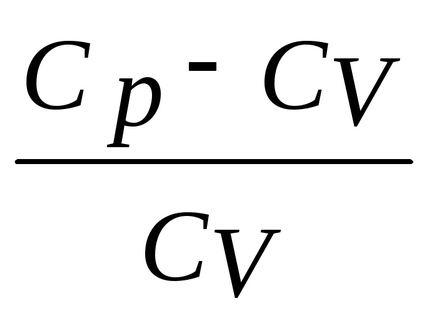
având în vedere că
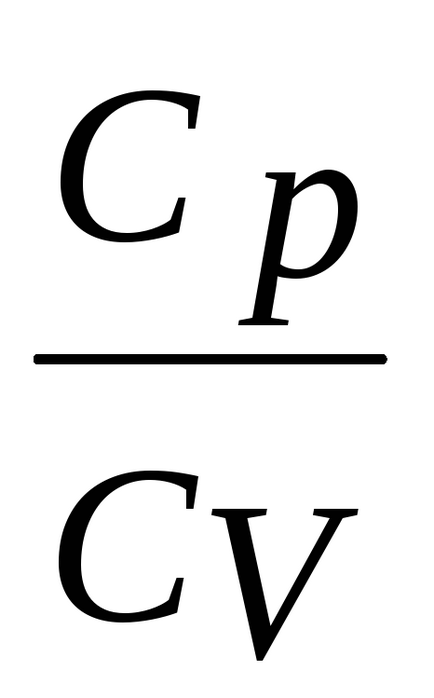
proces adiabatic Ecuația are forma
R1v1 = r2v2 sau p V = const
indicele adiabatic gde-. Pentru a trece la p și T peremennymTiVili exclud din ultima ecuație presiune sau volum, folosind ecuația lui Mendeleev-Clapeyron. Atunci obținem:
Tv-1 = const; sau tp1- = const.
Printre adiabatic și pot include procese rapide, în cazul în care timpul în care o modificare a volumului de gaz este semnificativ mai mică decât timpul necesar pentru stabilirea echilibrului termic cu organele din jur.
Utilizarea sub proces adiabatic are loc datorită schimbării energiei interne
Noi rescrie această ecuație în forma
Folosind ecuația adiabatic TV-1 = const, înlocuiți raportul
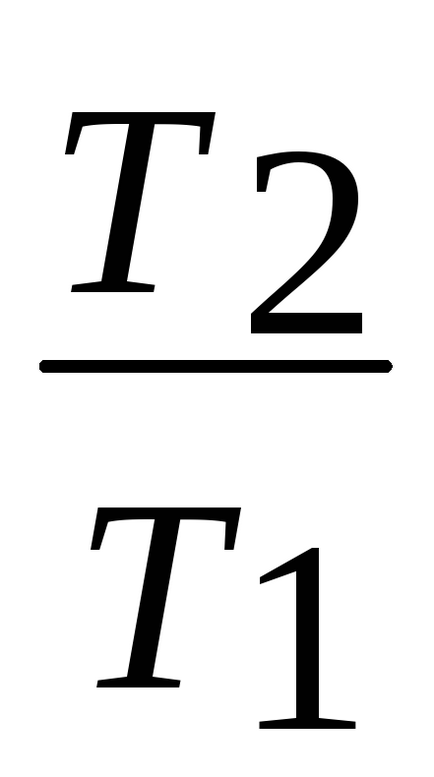
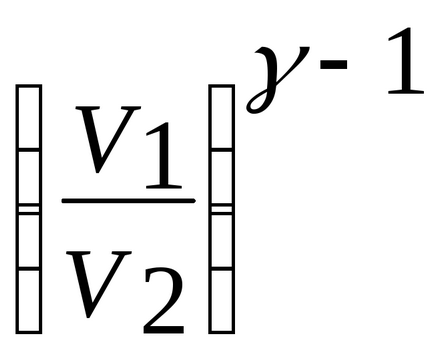
Deci, kakR = Cp-CVI au
Când adiabatic de lucru de expansiune a gazelor se realizează prin reducerea energiidU = -Ai temperatura internă a gazului este coborâtă; sub compresie adiabatică crește energia internă a gazului și temperatura acestuia crește.
Deoarece comprimarea gazului adiabatic, temperatura crește, crește presiunea gazului mai rapid decât comprimarea izotermă. Scăderea temperaturii gazului la destinderea adiabatică determină presiunea gazului care scade mai repede decât expansiunea izoterm.
Stare sistem. procese reversibile și ireversibile.
organisme de sistem, sau pur și simplu un sistem îl numim COBOL-kupnost a organelor. Un exemplu de sistem este un lichid și este în echilibru cu vaporii săi. In particular, in B Stem poate consta dintr-un singur corp.
Orice sistem poate fi în diferite stări, temperaturi diferite, presiune, volum, și așa mai departe. E. cantitățile Similaritatea-VASTE care caracterizează starea sistemului, numit parametri de stat.
Nu este întotdeauna un parametru are o anumită valoare. Dacă, de exemplu, temperatura de la diferite puncte ale corpului variază, corpul nu poate fi atribuită o valoare parametraT.V certă acest caz se numește o stare de non-echilibru. Pentru statele neechilibru parametrii care definesc starea sistemului, nu are valori specifice.
În cazul în care un astfel de organism este izolată de alte organisme și să se asigure, temperatura este aliniată și primește aceeași pentru toate punctele de pe valoarea T - corpul intră într-o stare de echilibru. Această valoare T nu este schimbat, atâta timp cât organismul nu va fi retras din echilibru influența starea Nogo din exterior.
Același lucru se poate ține pentru alți parametri, de exemplu, măsuri pentru a lua gaz davleniyar.Esli închise într-o formă cilindrică cer vas închis cu un piston și cu piston glisant ermetic de a începe rapid, apoi sub ea formează o pernă de gaz, presiunea care este mai mult decât în restul volumului de gaz. În consecință, gazul în acest caz, poate fi caracterizat printr-o davleniyar valoare definită și starea sa va fi răsări inegal. Cu toate acestea, în cazul în care mișcarea de oprire a pistonului, presiunea în diferite puncte ale volumului și a gazelor aliniate intră într-o stare de echilibru.
O situație similară întâlnim atunci când sunt instalate și SRI echilibru între lichid și vapori într-un vas închis. Vaporii de deasupra lichidului se formează prin evaporare - circa Cess, care constă în aceea că moleculele de lichid, cu viteză mare, lăsați lichidul de la suprafața sa. Dar unele dintre molecule, lichidul lăsat la haotic lor de mișcare-zhenii poate ajunge înapoi în ea, și se întâmplă mai des, cu atât mai mult aburul generat. Echilibrul între lichid și vaporii săi are loc atunci când numărul de molecule care părăsește lichidul pe unitatea de timp devine egal cu numărul de molecule, revenind din vaporii în acesta. Vapor devine saturat, și după aceea, nu modificări macroscopice în sistem nu se va întâmpla, - presiunea și temperatura rămân constante. Hod Nako moleculele de randament ale lichidului și întoarcerea lor pro-pereche fiind continuată și după echilibrare. În acest caz, este posibil ca o stare de echilibru în părți cuplu densitatea de volum poate devia ușor față de medie, m. E. Densitatea aburului saturat.
Aceste exemple arată două caracteristici de echilibru de stat. În primul rând, conceptul de echilibru termodinamic este sigur idealizare, pentru că, strict vorbind, parametrii de stat în echilibru nu rămân constante, dar se simt mici vibratii in apropiere (medie) valorile lor de echilibru. Astfel de oscilații, așa cum este indicat mai sus, nazyvayutsyafluktuatsiyami.Vo În al doilea rând, echilibrul termodinamic se poate spune doar că, în cazul în care numărul de particule care alcătuiesc sistemul, este foarte mare.
Astfel, starea de echilibru a sistemului este numit, INDICA o stare în care toți parametrii sistemului au anumite valori, care rămân în condiții externe constante constante pe termen nelimitat.
Procesul de tranziție de la o stare de neechilibru de echilibru în procesul de relaxare egal-numit sau relaxare pro-sute. Timpul petrecut pe o astfel de tranziție este numit timpul de relaxare. Timpul de relaxare este luată ca momentul în care inițial-nenie Discrepanța oricărei cantități de valoarea de echilibru scade Veraz. Pentru fiecare parametru al sistemului are propriul timp relak-Sation. Cel mai mare dintre aceste vremuri joacă rolul de timp a sistemului de relaxare-TION.
Dar când soldul a fost deja stabilit, sistemul nu poate, așa cum se arată experiența de a reveni la starea de neechilibru inițială. Cu alte cuvinte, schimbarea este-TION care a fost supus sistemului, care trece în starea de echilibru, nu poate avea loc în direcția opusă, fără externe Cart-activități.
De exemplu, dacă două corpuri în contact au o diferență de temperatură mai întâi, și au fost lăsate să se, în final, ambele corpuri sunt aliniate temperatură. Cu toate acestea, procesul invers - nu se produce fără influență externă - creșterea diferenței de temperatură dintre ele.
Gazul în sine este întotdeauna uniform distribuit în întregul volum al vasului și această stare corespunde echilibrului. Dar de gaz nu se va acumula într-o parte a navei pentru mai multe co-lichestve (densitate mai mare) decât celălalt, fără acțiunea forțelor externe.
În mod similar, în cazul în care vom introduce două nave de gaze diferite, atunci ele sunt amestecate din cauza difuziei reciprocă, astfel încât amestecul să fie peste tot la fel. Aceasta va fi starea de echilibru. Cu toate acestea, în scopul de a re-diviza aceste gaze trebuetsyazatratit eforturi mari din exterior.
Aceste exemple indică o caracteristică importantă a pro-proceselor care au loc în sistemele moleculare - asupra ihneobratimost.Etim proceselor moleculare difera de pur mecanic, care sunt caracterizate prin strogayaobratimost.
protsessomnazyvaetsya Reversible o astfel de schimbare starea sistemului (sau un singur organism), care, atunci când sunt efectuate în direcția inversă, se întoarce la starea inițială, astfel încât sistemul a trecut prin aceeași stare intermediară ca și în procesul direct, dar în ordine inversă, și starea organisme din afara sistemului a rămas neschimbat.
Obratimymiyavlyayutsya toate propunerile considerate în mine-mecanică, și cu excepția celor care implică frecare. Acțiunea forțelor de frecare conduce la căldură generație, (adică, crește puterea de mișcare a particulelor microscopice în organism și mediu), iar procesul nu mai este un pur mecanic. Acest proces are loc în mod spontan. Este diferit cu procesul invers. Pentru a readuce sistemul la starea inițială, este necesar ca organismul a fost în mișcare din nou, de energia eliberată în timpul răcirii și a mediului său. Experiența arată că mișcarea aleatorie a particulelor în organism nu poate provoca în mod spontan mișcarea ordonată a particulelor în ansamblu. Pentru acest proces necesită un proces suplimentar de compensare așa-numitele. Acest proces ar trebui să fie la corp și mediul de răcire la temperatura inițială, adică în a da orice alt organism de căldură și Comisia cu privire la activitatea organismului. Prin urmare, deși rezultatul sistemului direct și invers proceselor de mediu a corpului și a revenit la starea inițială, starea organelor externe se schimbă. În consecință: toate procesele sunt însoțite de frecare ireversibilă.
Procesul de transfer de căldură între două corpuri, la temperaturi diferite conduce la egalizarea energia medie a mișcării termice a particulelor celor două corpuri, adică egalizarea temperaturii Tel.
Acest proces are loc în mod spontan furnizat cât mai curând contactul termic între corpurile. Este diferit cu procesul invers - încălzirea corpului prin răcire altul. Spontan, acest proces nu are loc. Pentru a pune în aplicare este necesar să se utilizeze mașini de refrigerare, a căror activitate este legată de schimbarea statutului altor organisme externe. Prin urmare: procesul de schimb de căldură la diferența de temperatură finală este, de asemenea, ireversibil.
In mod analog putem arăta de dizolvare ireversibilă, difuzie.
Un exemplu de proces reversibil poate fi undamped oscilații a corpului comise suspendat pe un arc în vid. După un timp egal cu perioada de starea sistemului este oscilații persistente. După un timp egal cu perioada de oscilație a stării sistemului se repetă. pentru că sistem izolat, schimbările care au loc în ea nu se schimba starea altor organisme. Astfel, acest proces este reversibil. În termodinamică, se dovedește că condiția necesară și suficientă pentru reversibilitatea procesului este echilibrul termodinamic.
În cazul în care axele de coordonate întârzie valorile oricăror doi parametri, orice stare de echilibru a sistemului poate fi reprezentat de punctul de pe planul de coordonate (a se vedea. De exemplu, tochku1na Fig. 14). starea de neechilibru nu pot fi afișate în acest fel, pentru că cel puțin unul dintre parametrii nu vor fi într-un neechilibru valori lennogo definite de stat.
Fiecare proces, adică. E. Trecerea de la o stare la alta, implică o încălcare a echilibrului. În consecință, în timp ce curge în procesul de cineva sistem-ka trece printr-o secvență constând neravnove-talie-TION. Referindu-se la comprimarea gazului de proces deja discutate într-un vas închis cu un piston, se poate concluziona că o încălcare-rav de echilibru atunci când pistonul este deplasat, cu atât mai semnificativ este făcută mai repede decât comprimarea gazului. Dacă pistonul este deplasat lent, echilibrul este rupt și presiunea ușor la punctele de timp-TION diferă puțin de o anumită limită medie znacheniyar.V, în cazul în care gazul este comprimat infinit lent, gaz la fiecare moment se va caracteriza valoarea presiunii determinata lennym. Prin urmare, în acest caz, gazul co vivace la fiecare moment este un echilibru, și infinit proces lent va consta dintr-un stări Debit secvență de echilibru, a se vedea. Fig.14.
Procedeul constă dintr-o secvență continuă de stat egal la echilibru se numește echilibrul sau cvasi-zistaticheskim. Din aceasta rezultă că echilibrul nu poate fi decât proces infinit de lent.
Toate procesele reale nu sunt în echilibru. Ele apar la o viteză finită, dar în unele cazuri, natura neechilibru a proceselor reale pot fi neglijate (mai lent procesul are loc, deci este mai aproape de echilibru).
La flux suficient de scăzută de procese reale pot apropia arbitrar de aproape de echilibru.