proces adiabatic - studopediya
4. Un proces adiabatic. Dacă nava cu expansiune gaz izolat de mediul înconjurător, atunci nu va fi nici un schimb de căldură, adică. E. Q = 0. Procesul care are loc atunci când această condiție este numită adiabatic.
Prima lege a termodinamicii ecuație, luând în considerare starea Q = 0 PRINI-view, maet
0 = # 916; U + A sau A = - # 916; U. (109)
În consecință, într-o lucrare de proces adiabatic se face doar în detrimentul energiei interne a gazului. Într-o expansiune adiabatică gazul funcționează și energia sa internă, și, prin urmare, scădere a temperaturii. Dacă munca de compresie adiabatică a gazului este negativ (mediul funcționează pe gaz), energia internă și crește temperatura gazului.
proces adiabatic poate fi pus în aplicare în mod substanțial în absența bună izolație termică. Dar, atunci este necesar să se efectueze procesul atât de repede că, în timpul punerii sale în aplicare nu a avut loc nici un schimb de căldură semnificativă cu mediul extern.
Căldura specifică într-un proces adiabatic
Deducem ecuația curbei care arată diagrama procesului adiabatic rV-. Ecuația de stare de moli de gaz are forma
Atunci când o schimbare infinitezimal în starea muncii efectuate de către A = PDV, iar schimbarea energiei interne în conformitate cu (83), # 916; U -> CV dT. Substituind aceste valori ale lui A și # 916; U în ecuația primei legi a termodinamicii (109), obținem:
Aceasta este ecuația adiabatic în formă diferențială. Deoarece conține toți cei trei parametri - P, V și T, - pentru excluderea unuia dintre ei face uz de ecuația de stare (111) pre-diferentiere-l
PDV + VDP = RDT. (113)
Înmulțind ecuația (112) pentru R, și (113) - pe CV iskladyvaya obține
Luând în considerare faptul că pentru un CV ideală de gaz + R = = Cp, ecuația divide (114) de produs CV pV și de a introduce notația
Atunci (114) ia forma
Având în vedere faptul că factorul constant # 947; puteți face transforma un semn diferențial (116) pentru a forma
d [# 947; lnV + LNP] = 0. (117)
Rezultă că cantitatea în paranteze, trebuie să fie constantă. Notam constantă ca ln (const). atunci
# 947; lnV + LNP = ln (const). (118)
Având în vedere că # 947; lnV = lnV # 947; și potențând expresia (118), obținem
pV # 947; = Const. (119)
Aceasta este ecuația adiabatic. De asemenea, este numită ecuația Poisson.
ca # 947; (. Figura 39)> 1 curba care reprezintă această ecuație este mai abruptă decât izotermelor pV = const. care comparația este prezentată în aceeași figură cu linii întrerupte. Se observă că scade sub izotermă, t. E. Gazul se răcește, iar curba de compresie adiabatică (119) se ridică deasupra izotermei, t. E. Gazul este încălzit prin expansiunea adiabatică a punctului curbei I (119). Cantitatea de funcționare a procesului adiabatic poate fi deosebit de simplu calculată folosind ecuația (109):
Folosind formula (115), ecuația (120) poate fi transformat:
Pentru a găsi T2 temperatura finală este posibilă combinarea (111) și (119), pentru a obține relația
televizor # 947; -1 = const. (122)
Pentru gaz monoatomic Cv = 12,5 kJ / (kmol * K), CP = Cv + R = kJ 20,8 / (kmol * K) și exponent adiabatic este egal cu aproximativ 1,67. Pentru gazele diatomice la temperaturi obișnuite. Pentru gazele poliatomice în cazul excitării grade de libertate de vibrație a CP capacității de căldură și Cv sunt chiar o valoare mai mare și un exponent adiabatice
chiar mai aproape de unitate.
Mare viteză motoare cu combustie internă și la gazele de expirare prin procesul de expansiune a gazelor cu jet ajutaj are loc atât de rapid încât poate fi considerată ca fiind practic adiabatic și calculată prin ecuația (119).
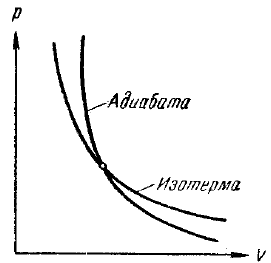
Fig. 39. adiabatică și o izotermă
Deoarece y> 1, atunci (122) care în timpul compresiei adiabatice a gazului este încălzit și o destindere adiabatică - răcită. Acest fenomen își găsește aplicarea în motoarele diesel, unde aprinderea amestecului combustibil se realizează prin comprimarea adiabatic. încălzirea gazului în compresie adiabatică, datorită faptului că, în timpul compresiei lucrării de gaz produs care va crește energia internă. Și ca energia internă a unui gaz ideal depinde numai de temperatura, această creștere a energiei interne se manifestă în creșterea temperaturii sale. In mod similar a explicat și răcirea gazului de expansiune adiabatică. Răcirea gazului prin expansiune adiabatică este utilizat în mașini frigorifice.